
- ავტორი Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- ბოლოს შეცვლილი 2025-01-22 17:03.
ატომში მხოლოდ გარკვეული ხაზების არსებობა სპექტრები ნიშნავდა, რომ ა ელექტრონი შეუძლია მიიღოს მხოლოდ გარკვეული დისკრეტული ენერგიის დონეები (ენერგია კვანტიზებულია); აქედან მოდის კვანტურის იდეა ჭურვები . ფოტონის სიხშირეები შთანთქა ან ემიტირებული ატომის მიერ ფიქსირდება ორბიტების ენერგიის დონეებს შორის განსხვავებები.
ამასთან დაკავშირებით, როგორ ითვალისწინებდა ბორის მოდელს ატომების ემისიის სპექტრები?
ბორის მოდელი წყალბადის ატომი მისდა დაკვირვებულს ზუსტი ახსნა ემისიის სპექტრი . ელექტრონებს შეუძლიათ ერთი ორბიტიდან მეორეზე გადაადგილება ენერგიის შთანთქმით ან გამოსხივებით, რაც იწვევს მახასიათებლებს სპექტრები.
რა მტკიცებულებები ადასტურებს ბორის მოდელს? ბორის მოდელი და ატომური სპექტრები მტკიცებულება ხოლმე მხარი დაუჭირეთ ბორის მოდელს მოვიდა ატომური სპექტრიდან. ბორი ვარაუდობენ, რომ ატომური სპექტრი იქმნება, როდესაც ატომში ელექტრონები ენერგეტიკულ დონეებს შორის მოძრაობენ.
ამასთან დაკავშირებით, რა მტკიცებულება არსებობს გარსებში ელექტრონების შესახებ?
იონიზაციის ენერგია - მტკიცებულება ამისთვის ჭურვები და ქვე- ჭურვები იონიზაციის ენერგია არის ა საზომი The მოცილებისთვის საჭირო ენერგიის რაოდენობა ელექტრონები ატომებიდან. როგორც ელექტრონები უარყოფითად არის დამუხტული და პროტონები შედიან The ბირთვები დადებითად არის დამუხტული, იქ იქნება მიმზიდველობა მათ შორის.
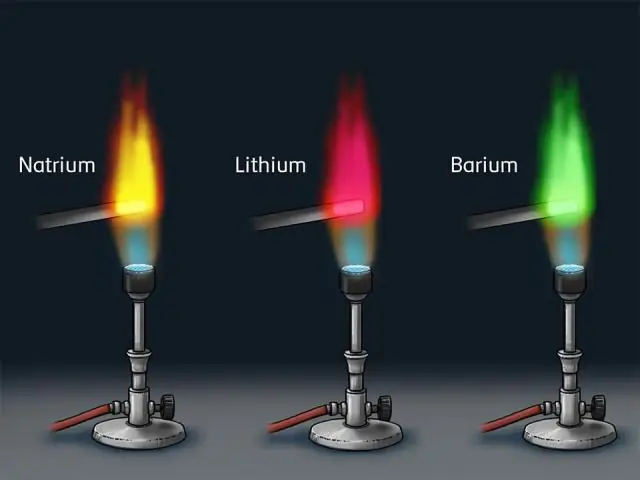
როგორ იპოვით ემისიის სპექტრს?
სინათლის სიხშირე, რომელსაც ატომს შეუძლია ასხივოს, დამოკიდებულია იმ მდგომარეობებზე, რომლებშიც შეიძლება იყვნენ ელექტრონები. აღგზნებისას ელექტრონი გადადის უფრო მაღალ ენერგეტიკულ დონეზე ან ორბიტალზე. როდესაც ელექტრონი ეცემა მიწის დონეზე, სინათლე არის ემიტირებული.
გირჩევთ:
როგორ წარმოიქმნება ატომების მიერ ნათელი ხაზის სპექტრები?

ის წარმოიქმნება ელემენტების ატომების ელექტრონების მიერ, რომლებიც ახტებიან დაბალ ენერგეტიკულ მდგომარეობებზე, მას შემდეგ, რაც ზევით აჯანყდებიან სხვა ატომთან ან შემომავალ ფოტონთან ან ელექტრონთან ან სხვასთან შეჯახების შედეგად. როგორც ამას აკეთებენ, ისინი ათავისუფლებენ დამატებით ენერგიას ფოტონების გამოსხივებით, ჩვეულებრივ, ერთი ფოტონი თითო გადასვლაზე
რით განსხვავდება ატომური ემისიის სპექტრები უწყვეტი სპექტრისგან?

უწყვეტი სპექტრი: სპექტრი, რომელსაც აქვს ყველა ტალღის სიგრძე ფართო დიაპაზონში ხარვეზების გარეშე. ემისიის სპექტრი: როდესაც აღგზნებულ მდგომარეობაში მყოფი ელექტრონი გადადის დაბალ ენერგეტიკულ დონეზე, ის ასხივებს გარკვეული რაოდენობის ენერგიას ფოტონების სახით. ამ გადასვლის სპექტრი შედგება ხაზებისგან, რადგან ენერგიის დონეები კვანტიზებულია
რა არის სტაბილური ორბიტა ბორის ატომურ მოდელში?

ატომს აქვს რამდენიმე სტაბილური ორბიტა, რომლებშიც ელექტრონს შეუძლია იცხოვროს გასხივოსნებული ენერგიის გამოსხივების გარეშე. თითოეული ორბიტა შეესაბამება გარკვეულ ენერგეტიკულ დონეს. 4. ბირთვის გარშემო არსებულ სპეციალურ ზედაპირს, რომელიც შეიცავდა თანაბარი ენერგიისა და რადიუსის ორბიტებს, ეწოდა გარსი
როგორ არის ემისიის სპექტრის მტკიცებულება ელექტრონულ გარსებზე?

ატომურ სპექტრებში მხოლოდ გარკვეული ხაზების არსებობა ნიშნავდა, რომ ელექტრონს შეუძლია მიიღოს მხოლოდ გარკვეული დისკრეტული ენერგიის დონეები (ენერგია კვანტიზებულია); აქედან მოდის კვანტური ჭურვების იდეა. ატომის მიერ შთანთქმული ან გამოსხივებული ფოტონების სიხშირეები ფიქსირდება ორბიტების ენერგეტიკულ დონეებს შორის განსხვავებებით
როგორ აღწერდა ნილს ბორმა ელექტრონები თავის ატომურ მოდელში?
ბორის ატომური მოდელი: 1913 წელს ბორმა შემოგვთავაზა ატომის კვანტური გარსის მოდელი, რათა აეხსნა, თუ როგორ შეუძლიათ ელექტრონებს ჰქონდეთ სტაბილური ორბიტები ბირთვის გარშემო. ელექტრონის ენერგია დამოკიდებულია ორბიტის ზომაზე და უფრო დაბალია მცირე ორბიტებისთვის. რადიაცია შეიძლება მოხდეს მხოლოდ მაშინ, როდესაც ელექტრონი გადახტება ერთი ორბიტიდან მეორეზე
