
- ავტორი Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- ბოლოს შეცვლილი 2025-01-22 17:02.
ქლორი იზოტოპი 18 ნეიტრონით აქვს სიმრავლე 0,7577 და მასური რიცხვი 35 ამუ. რომ გამოვთვალოთ საშუალოდ ატომური მასა, გაამრავლეთ წილადი მასის რიცხვზე თითოეულისთვის იზოტოპი , შემდეგ დაამატეთ ისინი ერთად.
ანალოგიურად, რა არის ელემენტის ყველა იზოტოპის საშუალო შეწონილი?
სხვადასხვა მასების გამოყენება იზოტოპები და რამდენად უხვი თითოეული იზოტოპი არის, ჩვენ შეგვიძლია ვიპოვოთ საშუალოდ ატომების მასა ელემენტი . ატომური მასა ელემენტი არის საშუალო შეწონილი ატომების მასა ბუნებრივად არსებულ ნიმუშში ელემენტი . ატომური მასა ჩვეულებრივ მოხსენებულია ატომური მასის ერთეულებში.
რა მასა აქვს 1 ამუს? ატომური მასის ერთეული (სიმბოლური AMU ან amu) განისაზღვრება, როგორც ნახშირბადის 12 ატომის მასის ზუსტად 1/12. ნახშირბად-12 (C-12) ატომს აქვს ექვსი პროტონები და ექვსი ნეიტრონები თავის ბირთვში. არაზუსტი თვალსაზრისით, ერთი AMU არის საშუალო პროტონი დასასვენებელი მასა და ნეიტრონი დასასვენებელი მასა.
მეორეც, როგორ გამოვთვალოთ პროცენტული სიმრავლე ატომური მასის გამოყენებით?
შეცვალეთ თითოეული პროცენტული სიმრავლე ათწილადის სახით 100-ზე გაყოფით. გაამრავლეთ ეს მნიშვნელობა ატომური მასა იმ იზოტოპის. დაამატე ყოველი იზოტოპი, რომ მიიღოთ საშუალო ატომური მასა.
რა განსხვავებაა ატომურ მასასა და ატომურ წონას შორის?
ატომური მასა (მა) არის მასა of an ატომი . სინგლი ატომი აქვს პროტონებისა და ნეიტრონების განსაზღვრული რაოდენობა, ამიტომ მასა არის ცალსახა (არ შეიცვლება) და არის პროტონებისა და ნეიტრონების რაოდენობის ჯამი ატომში . ატომური წონა არის საშუალო შეწონილი მასა ყველა ატომები ელემენტის, იზოტოპების სიმრავლის საფუძველზე.
გირჩევთ:
როგორ ვიპოვოთ საშუალო სიჩქარე ორი სიჩქარით?
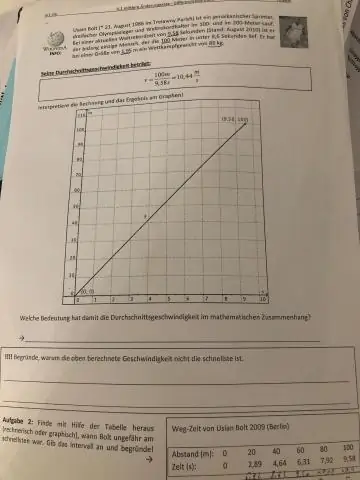
საწყისი და საბოლოო სიჩქარის ჯამი იყოფა 2-ზე საშუალოს საპოვნელად. საშუალო სიჩქარის კალკულატორი იყენებს ფორმულას, რომელიც აჩვენებს, რომ საშუალო სიჩქარე (v) უდრის საბოლოო სიჩქარის (v) და საწყისი სიჩქარის (u) ჯამს, გაყოფილი 2-ზე
როგორ გამოვთვალო პოპულაციის საშუალო მნიშვნელობა Excel-ში?
მოსახლეობის საშუალო = ყველა ერთეულის ჯამი / ერთეულების რაოდენობა პოპულაციის საშუალო = (14+61+83+92+2+8+48+25+71+12) / 10. მოსახლეობის საშუალო = 416 / 10. მოსახლეობის საშუალო = 41.6
როგორ პოულობთ გამოტოვებულ რიცხვს, როდესაც მოცემულია საშუალო?

რიცხვთა სიმრავლის საშუალო არის ამ რიცხვების საშუალო. თქვენ შეგიძლიათ იპოვოთ მნიშვნელობა რიცხვთა სიმრავლის დამატებით და გაყოფით რამდენი რიცხვია მოცემული. თუ მოგეცემათ მნიშვნელობა და გთხოვენ იპოვოთ გამოტოვებული რიცხვი ამ სიიდან, გამოიყენეთ მარტივი განტოლება
რა არის საშუალო შეწონილი მასა?

ელემენტის ატომური მასა არის ელემენტის იზოტოპების მასების შეწონილი საშუალო. ელემენტის ატომური მასა შეიძლება გამოითვალოს იმ პირობით, რომ ელემენტის ბუნებრივად არსებული იზოტოპების ფარდობითი სიმრავლე და ამ იზოტოპების მასები ცნობილია
როგორ მოვძებნოთ საშუალო დიაპაზონი კალკულატორზე?

საშუალო დიაპაზონის გამოსათვლელად, პირველ რიგში, იპოვეთ თქვენი მონაცემთა ნაკრების ყველაზე მაღალი და ყველაზე დაბალი რიცხვები. შემდეგ მაქსიმალური x მნიშვნელობისა და მინიმალური x მნიშვნელობის ჯამი გაყავით ორზე (2), ეს არის ფორმულა შუა რანგის გამოსათვლელად. მის გამოსათვლელად, თქვენ უნდა მოაწყოთ თქვენი მონაცემები უმაღლესიდან ყველაზე დაბალამდე ან ყველაზე დაბალიდან ყველაზე მაღალამდე
