
Სარჩევი:
- ავტორი Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:37.
- ბოლოს შეცვლილი 2025-01-22 17:03.
12.38 თითოეული წყვილიდან რომელი აქვს The უფრო მაღალი ორთქლის წნევა (ა) C2H6 ან C4H10 : C2H6 აქვს The უფრო მაღალი ორთქლის წნევა. არსებობს მხოლოდ დისპერსიული ძალები და ეს უფრო ძლიერია მძიმეში C4H10 მოლეკულა. ასეთ შემთხვევებში უფრო მძიმე მოლეკულები, რომლებიც აქვს უფრო ძლიერი დისპერსიული ძალები, ნება აქვს The უმაღლესი დუღილის წერტილი.
შესაბამისად, c3h8 ან c4h10 აქვს უფრო მაღალი დუღილის წერტილი?
C2H6 < C3H8 < C4H10 . ყველა ეს ნაერთი არის არაპოლარული და მხოლოდ აქვს ლონდონის დისპერსიული ძალები: რაც უფრო დიდია მოლეკულა, მით უფრო დიდია დისპერსიული ძალები და უფრო მაღალი The დუღილის წერტილი.
ანალოგიურად, რომელს ექნებოდა უფრო მაღალი დუღილის წერტილი? ოთხი ინტერმოლეკულური ძალის ფარდობითი სიძლიერეა: იონური > წყალბადის კავშირი > დიპოლური დიპოლი > ვან დერ ვაალის დისპერსიული ძალები. თითოეული ამ მიმზიდველი ძალის გავლენა ნება დამოკიდებულია არსებულ ფუნქციურ ჯგუფებზე. დუღილის წერტილები იზრდება ნახშირბადის რაოდენობის გაზრდით.
ასევე იცით, რომელ ნაერთს ელოდებით უფრო მაღალი დუღილის წერტილით?
რაც უფრო ძლიერია ინტერმოლეკულური ძალა, მით უფრო მაღალი The დუღილის წერტილი . ზოგადად, წყალბადის კავშირი უფრო ძლიერია, ვიდრე დიპოლ-დიპოლური ატრაქციონები, რაც არიან უფრო ძლიერი ვიდრე ლონდონის დისპერსიული ძალები.
როგორ განვსაზღვროთ დუღილის წერტილი?
დუღილის წერტილის ამაღლების მაგალითი
- გლუკოზა არის ჩვენი გამხსნელი, ხოლო წყალი არის გამხსნელი.
- Kb წყლისთვის არის 0,51 გრადუსი ცელსიუსი კგ/მოლი.
- გლუკოზის მოლური მასა არის 180 გ/მოლი.
- წყლის დუღილის წერტილი 100 გრადუსია.
- დუღილის წერტილის ამაღლების განტოლება არის დელტა T = mKb.
გირჩევთ:
ეთანს ან ეთენს აქვს უფრო მაღალი დუღილის წერტილი?

ეთანს აქვს უფრო ძლიერი ინტერმოლეკულური მიზიდულობა (ვან დერ ვაალის ძალები), ვიდრე ეთენი და ასევე აქვს უფრო მაღალი დუღილის წერტილი
რატომ აქვს ეთილის სპირტს უფრო მაღალი დუღილის წერტილი, ვიდრე მეთილის სპირტი?

ეთანოლს უფრო მაღალი დუღილის წერტილი აქვს ვიდრე მეთანოლს. შესაბამისად, მეტი ენერგიაა საჭირო ინტერმოლეკულური ძალების დასაძლევად, რაც იწვევს დუღილის/დნობის წერტილების ზრდას
ეთანოლს ან აცეტონს აქვს უფრო მაღალი დუღილის წერტილი?

მაშასადამე, ეთანოლს (H-შემაკავშირებელი სიმძლავრის მქონე) უნდა ჰქონდეს ყველაზე მაღალი დუღილის წერტილი, პოლარული აცეტონი აქვს შემდეგი უმაღლესი დუღილის წერტილი, ხოლო არაპოლარპროპანს, ყველაზე სუსტი ინტერმოლეკულური ძალებით, ექნება ყველაზე დაბალი დუღილის წერტილი. 41
რა აიძულებს ნაერთს უფრო მაღალი დუღილის წერტილი ჰქონდეს?

დიდ მოლეკულებს აქვთ მეტი ელექტრონი და ბირთვი, რომლებიც ქმნიან ვან დერ ვაალის მიზიდულ ძალებს, ამიტომ მათ ნაერთებს ჩვეულებრივ აქვთ უფრო მაღალი დუღილის წერტილი, ვიდრე მცირე მოლეკულებისგან შემდგარ მსგავს ნაერთებს. ძალიან მნიშვნელოვანია ამ წესის გამოყენება მხოლოდ მსგავსი ნაერთებისთვის
რატომ აქვს წყალს მაღალი დუღილის წერტილი და დნობის წერტილი?
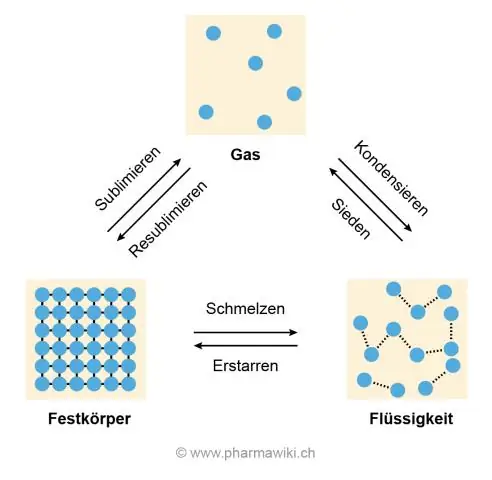
დნობისა და დუღილის მაღალი ტემპერატურის მიზეზი არის წყალბადის კავშირი წყლის მოლეკულებს შორის, რაც იწვევს მათ ერთმანეთთან შეკვრას და წინააღმდეგობას უწევს დაშლას, რაც ხდება, როდესაც ყინული დნება და წყალი ადუღდება და იქცევა გაზად
